Estructura terciaria de las proteínas
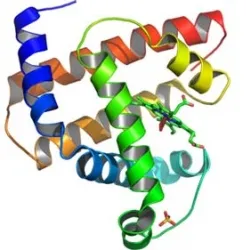
La cadena polipeptídica, aunque estabilizada por su estructura secundaria, puede aún sufrir giros y plegamientos, adquieriendo una disposición tridimensional conocida como estructura terciaria de la proteína. Un ejemplo de ello se aprecia en las figuras inferiores.
Las causas que determinan el plegamiento de la cadena peptídica se relacionan con la búsqueda de estabilidad de la molécula; determinadas interacciones fisicoquímicas entre diversas cadenas laterales de la molécula pueden originar una disposición tridimensional más estable en el medio en que se encuentre la proteína.
Las principales interacciones no covalentes que pueden establecerse entre las cadenas laterales de aminoácidos son:- Puentes de hidrógeno entre cadenas polares que presenten algún grupo que pueda actuar como aceptor o donador de hidrogeniones, como los grupos -OH de la serina o de la treonina. También pueden participar en estas interacciones los grupos C=O y N-H de los enlaces peptítidos no implicados en la estabilización de la estructura secundaria.
- Interacciones electrostáticas entre grupos con carga eléctrica opuesta, como puede ser un grupo carboxilo de una cadena lateral y un grupo amino de otra. También entrean en esta categoría las interacciones entre grupos químicos que sin presentar carga eléctrica neta sí que poseen un extremo con carga parcial positiva o negativa, como los grupos amida de la asparagina y la glutamina.
- Interacciones de Van der Waals, es decir, interacciones muy débiles entre grupos no cargados pero que pueden polarizarse por la presencia de una carga o por desplazamientos electrónicos temporales.
- Interacciones hidrofóbicas. Los grupos apolares no pueden interaccionar con el agua, medio en el que habitualmente se encuentran las proteínas; esto hace que aminoácidos apolares tiendan a interaccionar entre sí ocultándose del agua que envuelve la molécula.

Algunas de las interacciones entre cadenas laterales que conducen a la estabilización de la estructura terciaria de una proteína.

Estructura terciaria de una proteína que presenta varias hélices α y hojas plegadas adoptando una estructura tridimensional.
Hashtags:
#biologia#bioquimica#proteinas#estructura-primaria#estructura-secundaria#estructura-terciaria#estructura-cuaternaria#peptido#aminoacido#enlace-peptidico
Juan Luis Menéndez
Me gusta la divulgación de la naturaleza y el patrimonio cultural, motivos por los que he decidido comenzar el desarrollo de asturnatura.com. Soy un amante de la botánica y la geología.
Comparte en:
Índice:
- Los aminoácidos
- Carga eléctrica de los aminoácidos
- Estereoisomería de los aminoácidos
- Péptidos. Enlace peptídico
- Isomería del enlace peptídico
- Péptidos no proteicos
- Las proteínas
- Estructura primaria de las proteínas
- Estructura secundaria de las proteínas
- Estructura terciaria de las proteínas
- Estructura cuaternaria de las proteínas
- Proteínas conjugadas
- Clasificación de las proteínas
- Propiedades de las proteínas
Más populares en Bioquímica:
 Fases de la Meiosis
Fases de la Meiosis Los monosacáridos
Los monosacáridosPalabras clave:
Artículos similares
Citar como
Menéndez Valderrey, Juan Luis. "Estructura terciaria de las proteínas". asturnatura.com [en línea] Num. 130, 04/06/2007 [consultado el 15/4/2025]. Disponible en https://www.asturnatura.com.
ISSN 1887-5068