Métodos de estudio de la célula
Por: Aida Lorenzo Corchón
Desde la segunda mitad del siglo XVII en que Hooke y Leeuwenhoek realizaron las primeras observaciones de células al microscopio, se ha avanzado mucho en el conocimiento de la morfología y fisiología celular. Esto ha sido posible gracias a la ayuda de una serie de métodos de trabajo cada vez más precisos y específicos.
Estudios morfológicos: microscopía óptica y electrónica
Salvo algunas excepciones, la mayor parte de las células sólo pueden verse con ayuda de un microscopio. Por eso, el conocimiento de la célula empezó con la microscopía óptica, la cual todavía hoy en día es un instrumento esencial, junto con la mucho más reciente microscopía electrónica.
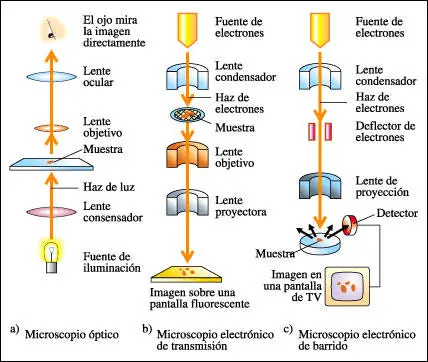
Características de los tres principales tipos de microscopios: óptico, electrónico y de barrido
Microscopía óptica
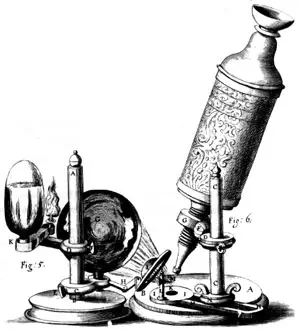
En 1590, el holandés Janssen utilizó un sistema de dos lentes para ampliar imágenes y construyó el primer microscopio óptico compuesto. En estos instrumentos, una de las dos lentes, llamada objetivo, se coloca muy cerca del objeto a observar y su efecto es una imagen invertida y aumentada; el segundo juego de lentes, llamado lente ocular, se coloca a una distancia tal que su efecto sea el aumento del tamaño de la imagen invertida, multiplicando el efecto de la lente objetivo.A finales del siglo XIX, se avanzó mucho en el conocimiento de las características internas de las células gracias al empleo de colorantes, que proporcionan el contraste suficiente para hacer visibles las estructuras celulares. El perfeccionamiento del microscopio óptico tenía como límite el llamado poder de resolución, es decir, la distancia mínima a la que pueden estar dos puntos para que se les vea separados. Este límite depende de la longitud de onda de la luz con que se ilumina el objeto. Para los microscopios ópticos que trabajan con luz visible, la resolución máxima que se puede obtener es de 0.2 µm (500 veces superior al poder de resolución del ojo humano).
El problema del poder de resolución es teóricamente distinto al del aumento. Así, aunque es posible agrandar una imagen, tanto como se desee, proyectándola, por ejemplo, sobre una pantalla, nunca lograremos diferenciar al microscopio óptico dos objetos que estén separados menos de 0.2 µm; dichos objetos se verán como uno solo.
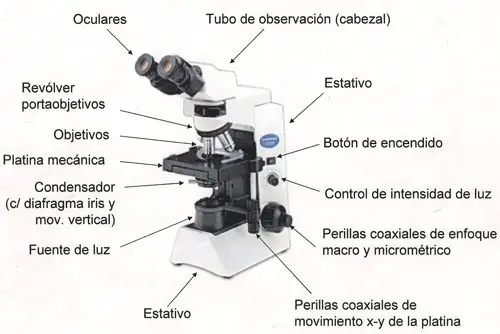
Diferentes partes de un microscopio óptico
La observación de células y tejidos al microscopio óptico requiere que las muestras se dejen atravesar por la luz, lo que obliga a la realización de cortes finos. Además, para observar los orgánulos celulares, generalmente transparentes, es necesario que exista un contraste óptico entre ellos, lo que se consigue mediante el empleo de colorantes.
La manipulación de las muestras para microscopía óptica
Al microscopio óptico podemos observar células vivas o células muertas fijadas y coloreadas.-
Se pueden observar células vivas sin someterlas a ningún tipo de manipulación, manteniéndolas durante su estudio en el medio adecuado. Con mayor frecuencia se necesita utilizar colorantes denominados vitales, que no dañan a las células y permiten visualizar algunas de sus estructuras. Entre estos colorantes están el azul de metileno, el verde Jano, rojo neutro, etc.
-
Sin embargo, en la mayoría de los casos se trabaja con preparaciones permanentes. Para eso, en primer lugar, las células han de ser tratadas con un fijador que las inmovilice y las mate.
Después de la fijación, los tejidos deben ser cortados en finas secciones con un micrótomo, máquina con una cuchilla muy afilada y que funciona de forma similar a un cortafiambres. Dado que generalmente los tejidos son blandos y frágiles, antes de la obtención de los cortes es necesario incluirlos en un medio de soporte para endurecerlos. El medio más utilizado es la parafina. En algunos casos, la muestra se endurece por congelación y se corta con un micrótomo especial.
El siguiente paso es la tinción, para lo cual se utilizan colorantes que se fijan selectivamente sobre los diferentes orgánulos celulares. Para ser observadas al microscopio, las secciones teñidas se colocan sobre un portaobjetos cubiertas con un cubreobjetos.

Muestras de esporas y del hongo Podospora obtenidas por cortes finos y tinción de la muestra
Muchas veces al someter a las células a estos procesos, se producen sin querer diversos "artefactos", que de alguna manera, pueden falsear los resultados obtenidos.
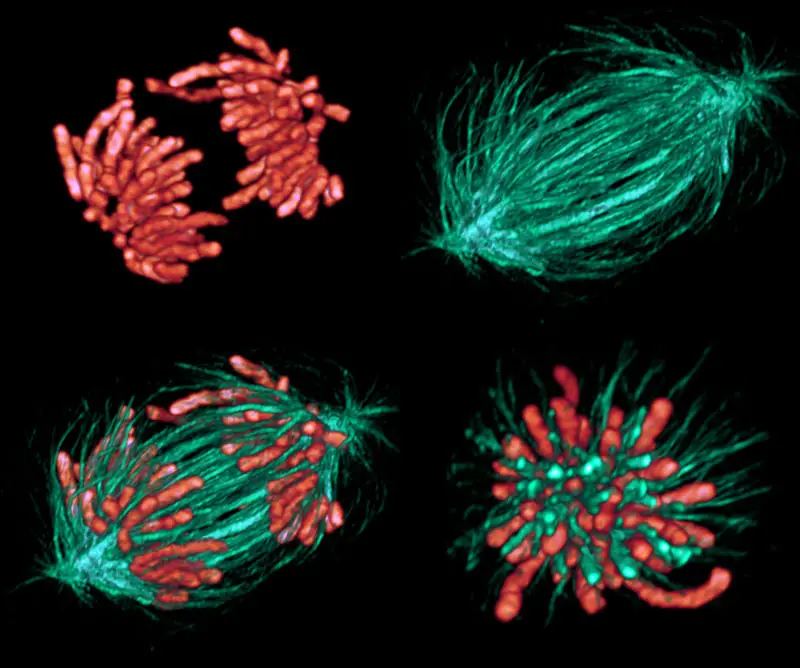
Actualmente existen microscopios ópticos especiales que permiten visualizar estructuras en células vivas sin necesidad de ningún tipo de manipulación. Se trata de microscopios de contraste de fases, de contraste de fases interferencial y de campo oscuro. Una de las principales ventajas de estos microscopios es que se pueden observar las células en acción y estudiar los movimientos intracelulares que se producen en procesos como la mitosis.
Microscopio electrónico
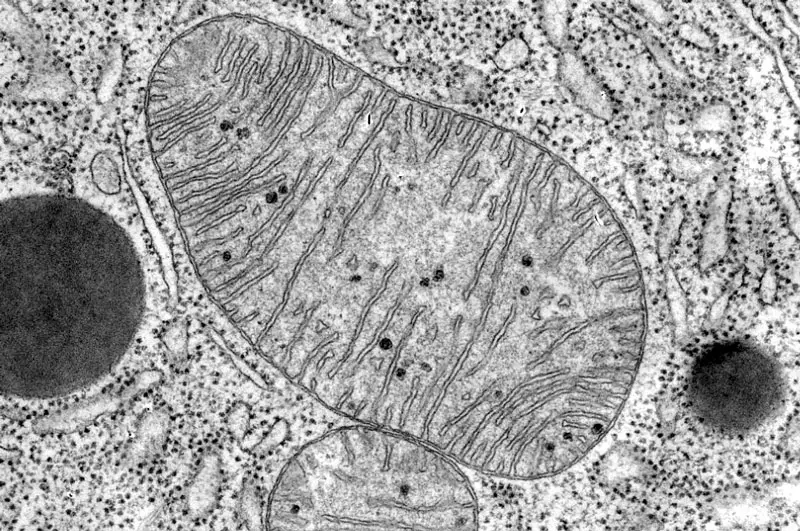
 En 1931 se construyó el primer microscopio electrónico que utiliza como fuente de "iluminación" un haz de electrones en vez de rayos de luz. Con estos microscopios se consigue una resolución normal para los objetos biológicos de 2 nm, o sea, unas 100 veces mayor que la resolución del microscopio óptico.
El microscopio electrónico de transmisión es, en rasgos generales, similar al microscopio óptico pero de mayor tamaño e invertido. Está formado por una columna o tubo en la que se hace el vacío y que tiene un cátodo en su parte superior que emite electrones. Estos son context-centers sobre el plano donde se dispone la muestra mediante un electroimán pasa a través de la muestra y a continuación dos electroimanes que funcionan como lentes dan una imagen agrandada del objeto, que se proyecta para su observación sobre una pantalla fluorescente o una placa fotográfica. Las áreas o partes de la muestra que son más "transparentes" a los electrones aparecen de color brillante, mientras que las que son más "opacas" aparecen oscuras.
En 1931 se construyó el primer microscopio electrónico que utiliza como fuente de "iluminación" un haz de electrones en vez de rayos de luz. Con estos microscopios se consigue una resolución normal para los objetos biológicos de 2 nm, o sea, unas 100 veces mayor que la resolución del microscopio óptico.
El microscopio electrónico de transmisión es, en rasgos generales, similar al microscopio óptico pero de mayor tamaño e invertido. Está formado por una columna o tubo en la que se hace el vacío y que tiene un cátodo en su parte superior que emite electrones. Estos son context-centers sobre el plano donde se dispone la muestra mediante un electroimán pasa a través de la muestra y a continuación dos electroimanes que funcionan como lentes dan una imagen agrandada del objeto, que se proyecta para su observación sobre una pantalla fluorescente o una placa fotográfica. Las áreas o partes de la muestra que son más "transparentes" a los electrones aparecen de color brillante, mientras que las que son más "opacas" aparecen oscuras.Los materiales que se observan han de ser sometidos a una serie de manipulaciones: fijación, inclusión en resinas duras para poder hacer secciones ultrafinas de las células o tejidos utilizando micrótomos especiales (ultramicrotomos), tinción, etc.
En el microscopio electrónico tridimensional o de barrido los electrones no atraviesan la muestra, que está recubierta por una finísima capa de oro. En este caso, un haz de electrones muy estrecho es dirigido hacia la superficie de la muestra y ésta emite unos electrones secundarios que son los que se detectan en la pantalla. Las imágenes así obtenidas dan una apariencia tridimensional de la superficie del material observado.


Microscopio de barrido y esporas de un hongo vistas con dicho microscopio
Estudio bioquímico de la célula
Para conocer la composición y la función de los orgánulos y otros componentes celulares se separan, en primer lugar, las diferentes estructuras de la célula y después se estudian mediante métodos bioquímicos y métodos mixtos, microscópico-bioquímicos.Fraccionamiento celular
Se trata de un método de aislamiento y separación de los orgánulos celulares, con objeto de estudiarlos después independientemente. Para ello se siguen los siguientes pasos:-
Se realiza un homogeneizado del tejido a estudiar mediante tratamientos químicos o físicos que rompan las células, como por ejemplo, choque osmótico o trituración. Este proceso debe hacerse con la mayor suavidad posible con el fin de que ese rompa la membrana plasmática pero queden intactos orgánulos tales como el núcleo, las mitocondrias, los lisosomas, los peroxisomas y el complejo de Golgi. El homogeneizado se disuelve en una solución salina o de azúcar (normalmente sacarosa).
-
A continuación, se separan los diferentes componentes del homogeneizado, en función de su densidad, mediante un instrumento llamado ultracentrífuga. Primero el homogeneizado se somete a centrifugación a baja velocidad separándose los orgánulos más densos (núcleos) en el precipitado y los menos densos en el sobrenadante (mitocondrias, ribosomas
); el sobrenadante se decanta para ser sometido de nuevo a centrifugación a mayor velocidad y así sucesivamente se obtienen una serie de fracciones en los diversos precipitados que contiene los distintos orgánulos celulares.
Dependiendo de las características de la centrifugación, entre 500 y 1000g durante 10 minutos se observan núcleos y cloroplastos, de 10000 20 000 durante 30 minutos mitocondrias y lisosomas y a 100.000 g durante 90 minutos el RE rugoso y ribosomas.
Marcadores radiactivos. Autorradiografía
Cualquier molécula puede "marcarse" incorporándole uno o más isótopos radiactivos. La radiación que emiten los núcleos de estos átomos permite detectar la molécula marcada y seguir sus movimientos. De esta forma, si se introduce en una célula un compuesto orgánico que contenga átomos radiactivos, se puede seguir su paso a través de los orgánulos celulares y estudiar sus funciones. Entre los isótopos radiactivos usados en biología están: 14C, 3H, 32P y 35S.La técnica, denominada autorradiografía, se utiliza para localizar las sustancias marcadas radiactivamente en secciones de células enteras o de tejidos, aunque más que la localización estática de un compuestos lo que interesa son sus desplazamientos a nivel intracelular y tisular.
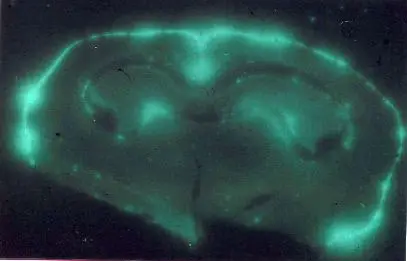
Autorradiografía de una muestra de tejido cerebral de conejo
El proceso consiste en lo siguiente: las células vivas se exponen durante un tiempo, generalmente breve, a un compuesto radiactivo, transcurrido el cual dicho compuesto se elimina del medio. Las células así marcadas se fijan sobre un porta, se recubren con una fina capa de una emulsión fotográfica y se dejan en la oscuridad durante unos días, tras los cuales se revela la emulsión y se observa al microscopio. La radiactividad emitida impresiona la placa fotográfica, por lo que al revelar la película aparecen manchas oscuras que determinan la posición de la sustancia "marcada".
Cultivo celular
La mayoría de la células, tanto animales como vegetales, sobreviven, se dividen en incluso se diferencian en un medio de cultivo en condiciones adecuadas. Luego, las células se pueden utilizar para visualizarlas al microscopio o para analizarlas bioquímicamente.El interés por el cultivo de células y tejidos tiene importantes aplicaciones en el campo de la biología experimental, Medicina, Veterinaria, Agricultura, etc. Los cultivos de células y tejidos han permitido conocer el proceso de la mitosis, los movimientos celulares, la respuesta de la célula frene a sustancias tóxicas, bacterias, virus, etc. También se pueden estudiar los efectos de la adición o eliminación al medio de cultivo de moléculas específicas tales como hormonas o factores de crecimiento.
Uno de los avances más importantes en los cultivos de tejidos ha sido la puesta a punto de la técnica de aislamiento de clones, que consiste en hacer cultivos procedentes de una única célula esta técnica es muy útil para diversos estudios genéticos.

Artículos similares
Citar como
Aida Lorenzo Corchón. "Métodos de estudio de la célula". asturnatura.com [en línea] Num. 423, 06/05/2013 [consultado el 4/4/2024]. Disponible en https://www.asturnatura.com/temarios/biologia/estructura-funcion-celular/metodos-estudio-celula.
ISSN 1887-5068