Las enzimas
En general, todas las reacciones metabólicas están reguladas por las enzimas, unas proteínas globulares que actúan como catalizadores, aumentando la velocidad de aquellas reacciones que son energéticamente posibles.
Las enzimas permiten las reacciones en condiciones de temperatura, presión y pH propios del medio intracelular, reduciendo la energía de activación necesaria para que se produzca la reacción. Las enzimas no experimentan cambios estructurales al final del proceso que catalizan.

A mediados de siglo XIX el científico francés Louis Pasteur, estudiando la fermentación alcohólica, descubrió las enzimas que inicialmente describió como fermentos. Pasteur creía que la actividad enzimática era inseparable de las células vivas, pero en el año 1897 Eduard y Hans Buchner consiguieron extraer y separar, sin que perdieran su capacidad catalítica, las mismas enzimas de las correspondientes células.
A principios del siglo XX, E. Fischer observó la especificidad y en el año 1926 J. Summer obtuvo la primera enzima cristalizada y purificada, la ureasa.
Nomenclatura y clasificación de las enzimas
Aunque hay enzimas que conservan la denominación inicial sin ninguna alusión a su función catalítica, como las enzimas digestivas tripsina y pepsina, actualmente cada enzima tiene asignados dos nombres: el primero, el nombre recomendado, consta del sufijo -asa precedido del nombre del reactivo o sustrato de la reacción, como por ejemplo la ureasa o la fumarasa, o bien a partir del mismo sufijo y de la acción química realizada, como la lactato deshidrogenasa y la adenilato ciclasa.
La Unión Internacional de Bioquímica y Biología Molecular (UIBMB) ha desarrollado todo un sistema de clasificación y nomenclatura de las enzimas, donde el sufijo -asa se une a una descripción de la reacción catalizada. Un ejemplo: la gliceraldehido 3-fosfato NAD oxidorreductasa.
La clasificación de las enzimas de la UIBMB consta de siete grandes grupos:
- Oxidorreductasas: catalizan las reacciones metabólicas de tipo oxidación-reducción.
- Transferasas: catalizan los intercambios de grupos metilo, amino o fosfato, entre otros.
- Hidrolasas: catalizan hidrólisis.
- Liasas: enzimas que rompen enlaces tipo C-C, C-S o C-N.
- Isomerasas: enzimas que catalizan las reacciones de cambio de posición de átomos en una misma molécula o de isomerización.
- Ligasas o sintetasas: enzimas que catalizan reacciones de formación de enlaces del C con el O, con el S o con el N, y acopladas a la desfosforilación de ATP.
Propiedades de las enzimas
- Las enzimas tienen un lugar llanado centro activo o centro catalítico, que está formado por unos determinados segmentos de la cadena de aminoácidos de la enzima (E) que determinan una superficie tridimensional complementaria a la molécula del reactivo o del sustrato (S).
El centro activo se une al sustrato mediante interacciones iónicas, hidrofóbicas o por puentes de hidrógeno, formándose así el complejo enzima-sustrato (ES). De hecho, existe una complementaridad entre el centro activo y la molécula del sustrato, de modo que si el sustrato posee una carga negativa, en el centro activo hay aminoácidos con cargas positivas en las cadenas laterales (grupos R); si en el sustrato hay átomos aceptores de puentes de hidrógeno, en el centro activo deben encontrarse aminoácidos con grupos R donadores de puentes de hidrógeno.

Esquema del estado energético de una reacción química en el transcurso del tiempo
Existen dos tipos de acoplamiento. El modelo de llave-cerradura implica un acoplamiento rígido entre la enzima y el sustrato. Por el contrario, según el modelo del ajuste inducido de Koshland, entre el centro activo y el sustrato hay también una complementaridad espacial inicial que va acompañada de una flexibilidad de la cadena de aminoácidos de la enzima que provocaría la adaptación completa de la estructura de la enzima a la molécula del sustrato.
Esta unión cambia el sustrato y el complejo enzima-sustrato se transforma en el complejo enzima-producto. A continuación se separan la enzima de producto.

Esquema del estado energético de una reacción química en el transcurso del tiempo
- La mayoría de las reacciones catalizadas por enzimas son entre 1.000 y 10.000.000.000 veces más rápidas que si se producen sin ser catalizadas. Las enzimas aumentan la velocidad de las reacciones.
- Las enzimas, en general, solamente interactúan con uno o con muy pocos sustratos y catalizan tan solo un determinado tipo de reacción química; esta propiedad recibe el nombre de especificidad.
- Muchas enzimas están asociadas a cofactores no proteicos para poder ser funcionales, es decir, para poder catalizar las correspondientes reacciones metabólicas. Algunos cofactores son iones metálicos como el Zn2+, el Fe2+, el Cu2+ o el Mg2+; otros, llamados coenzimas, son biomoléculas o sustancias derivadas de las vitaminas (el CoA o coenzima A, el NAD+ o dinucleótido de nicotinamida, el FAD, o dinucleótido de flavina y adenina, etc.).
Un grupo prostético es una coenzima unida fijamente a la proteína u que no se puede disociar de la enzima, por ejemplo, la biotina (una vitamina del grupo B) que se une mediante un enlace covalente a las carboxilasas.
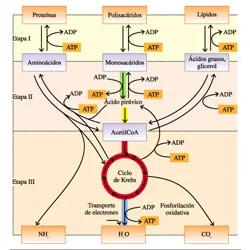
Llamamos holoenzima al complejo formado por la unión del cofactor o de la coenzima y la enzima; mientras que apoenzima es el término que designa la parte proteica de la holoenzima. En ausencia del correspondiente cofactor, las apoenzimas no son biológicamente funcionales. - Una parte sustancial de las enzimas de la célula se localizan en orgánulos específicos. Este compartimentación del metabolismo aisla determinados sustratos y productos, permitiendo así un ambiente favorable para cada tipo de reacción metabólica, evitando por un parte las interferencias provocadas por moléculas que tienen estructuras similares y que podrían dificultar o impedir las reacciones, y por otra parte, la compartimentación favorece el encadenamiento de las rutas metabólicas.
Cinética enzimática
Las enzimas no se consumen durante las reacciones metabólicas. Este hecho permite que las reacciones metabólicas sean eficaces y sus velocidades altas aunque la concentración de la enzima sea mucho menor que la del sustrato.
En general, cada molécula enzimática es capaz de transformar entre 100 y 1000 moléculas de sustrato en producto cada segundo. Cuando se forma el complejo enzima-sustrato, por cada macromolécula de ES quedan libres aún muchas moléculas de sustrato, de modo que una transformada la molécula de sustrato en producto, la enzima queda libre y puede iniciar un nuevo cilo de catálisis.
Los estudios sistemáticos del efecto de la concentración inical del sustrato sobre la actividad enzimática comenzaron a realizarse a finales del siglo XIX. Ya en 1882 se introdujo el concepto del complejo enzima-sustrato como intermediario del proceso de catálisis enzimática. En 1913, Leonor Michaelis y Maud Menten desarrollaron esta teoría y propusieron una ecuación de velocidad que explica el comportamiento cinético de los enzimas, conocido como el modelo de Michaelis-Menten.
Para explicar la relación oservada entre la velocidad inicial (v0) y la concentración inicial de sustrato ([S]0) Michaelis y Menten propusieron que las reacciones catalizadas enzimáticamente ocurren en dos etapas como se ha visto anteriormente: en la primera etapa se forma el complejo enzima-sustrato (ES) y en la segunda, el complejo enzima-sustrato da lugar a la formación del producto (P), liberando el enzima libre (E). A diferencia de lo que ocurre con los catalizadores no biológicos, las enzimas presentan una saturación por el sustrato. La velocidad de una reacción enzimática no crece linealmente con la concentración de sustrato, sino que tiende asintóticamente a un límite denominado velocidad máxima. La velocidad máxima se alcanza cuando prácticamente toda la enzima está en forma de ES. A la concentración de sustrato que corresponde una velocidad media de la velocidad máxima (Vmax/2) se conoce como Km. Km es una medida de la afinidad de la enzima por el sustrato: una Km baja indica gran afinidad, porque se requiere una baja concentración de sustrato para saturar la enzima, mientras que una Km alta supone poca afinidad.

La expresión más conocida de la ecuación de Michaelis-Menten es:

Hay que tener en cuenta que este modelo no sirve para todas las enzimas. Las enzimas cuya cinética obedece dicha ecuación se denominan enzimas michaelianas.
Factores que afectan a la actividad enzimática
Entre los diferentes factores que pueden favorecer o frenar una reacción catalizada por una enzima está en primer lugar la temperatura. Cada enzima tiene una temperatura óptima en la cual la velocidad de reacción es máxima, pero una vez superada dicha temperatura, la velocidad cae de repente hasta que se detiene la reacción, pues como todas las proteínas, las enzimas se desnaturalizan con el calor.
Las temperaturas óptimas de la mayoría de las enzimas están próximas a la temperatura corporal en animales endotermos. Hay, sin embargo, ejemplos de adaptaciones al medio muy notables, como algunas enzimas de peces de ríos fríos (las truchas por ejemplo) con temperaturas óptimas más bajas que las de sus congéneres que vienen en climas de temperaturas más suaves.

Un segundo factor que influye sobre la función enzimática es el pH. Cada enzima tiene su pH óptimo, relacionado con estructura proteica y la correspondiente distribución de cargas eléctricas en la cadena de aminoácidos de la enzima.
Inhibición de la actividad enzimática

Variación de la velocidad de una reacción enzimática con inhibidores
Determinadas sustancias, de estructura semejante al sustrato, compiten con el para unirse al centro activo de la enzima, en el mismo lugar que lo puede hacer el sustrato; así, cuando hay moléculas del sustrato disponibles para reaccionar y se encuentran con el centro activo ocupado, la reacción no tiene lugar. Este fenómeno recibe el nombre de inhibición competitiva.
La inhibición llamada no competitiva, en la cual la molécula de inhibidor se une a la enzima en una zona diferente del centro activo. Sin embargo, esta unión dificulta la formación del complejo ES o del complejo EP y la consiguiente formación del producto.
La inhibición acopetitiva supone que el inhibidor no se une en el mismo sitio que el sustrato, pero su unión al enzima aumenta la afinidad del sustrato por el enzima, dificultado su disociación e impidiendo la formación de los productos. En el esquema cinético más sencillo puede suponerse que el inhibidor se une al complejo de Michaelis ES, pero no al enzima y que el complejo ESI es improductivo.
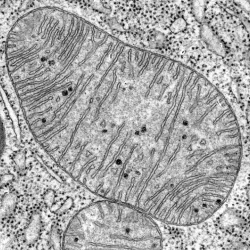
La unión de los inhibidores a la molécula de enzima es puede ser reversible. Otros inhibidores se unen de forma permanente, como hacn los venenos. Un inhibidor enzimático importante e irreversible es el cianuro, que inhibe la citocromo-oxidasa, una enzima ubicada en las crestas mitocondriales, paralizando así el catabolismo aerobio; los metales pesados como el plomo y el mercurio también inutilizan determinadas enzimas.

Inhibición enzimática
Enzimas reguladores
Las rutas metabólicas están catalizadas por grupos de enzimas que actúan secuencialmente, de tal manera que el producto de la reacción de un enzima es el sustrato de la siguiente.
En estas secuencias bioquímicas hay una enzima, generalmente la primera de la serie, que controla la velocidad de la ruta, porque cataliza la etapa más lenta. Estas enzimas reguladoras son capaces de aumentar o disminuir su actividad catalítica en respuesta a determinadas sustancias moduladoras. Gracias a esto, las necesidades de las células se atienden continuamente.
Según la relación entr la enzima y el modulador se distinguen dos tipos: las enzimas alostéricas, que se unen al modulador o moduladores no covalentemente, y las moduladas covalentemente.
Las enzimas alostéricas, además del centro activo possen uno o más sitios alostéricos, que son específicos, a los que se unen las moléculas de los moduladores. Estos moduladores pueden ser activadores o inhibidores de la actividad enzimática. Con frecuencia, los activadores son moléculas del sustrato de la enzima y los inhibidores moléculas del producto final de la ruta bioquímica. Hay también otras moléculas moduladoras.

Inhibición enzimática
Hay enzimas alostéricas que solo pueden ser activadas, otras que solo admiten la inhibición y otras que son susceptibles de ambos tipos de modulación.
En el metabolismo celular hay enzimas que activan o inactivan la formación de enlaces covalentes entre las cadenas laterales de los aminoácidos (serina, tirosina, treonina) de la enzima y grupos fosfato. Un par de ejemplos: la fosforilación de la glucógeno-fosforilasa activa dicha enzima, la cual, a su vez, degrada el glucógeno; al contrario, la fosforilación de la glucógeno-sintetasa disminuye la actividad de esta enzima que cataliza la síntesis del glucógeno.
Hashtags:
#metabolismo#anabolismo#catabolismo#enzima#autotrofo#heterotrofo#energia-libre#redox#fosforilacion#ruta-metabolica#celula
Juan Luis Menéndez
Me gusta la divulgación de la naturaleza y el patrimonio cultural, motivos por los que he decidido comenzar el desarrollo de asturnatura.com. Soy un amante de la botánica y la geología.
Comparte en:
Índice:
Más populares en Bioquímica:
 Fases de la Meiosis
Fases de la Meiosis Los monosacáridos
Los monosacáridosPalabras clave:
Artículos similares
Citar como
Menéndez Valderrey, Juan Luis. "Las enzimas". asturnatura.com [en línea] Num. 853, 02/08/2021 [consultado el 15/4/2025]. Disponible en https://www.asturnatura.com.
ISSN 1887-5068