El agua
Desde el punto de vista de la biología, el agua es un elemento crítico para la proliferación de la vida. El agua desempeña este papel permitiendo a los compuestos orgánicos diversas reacciones que, en último término, posibilitan la replicación de ADN. De un modo u otro, todas las formas de vida conocidas dependen del agua. Sus propiedades la convierten en un activo agente, esencial en muchos de los procesos metabólicos que los seres vivos realizan. Desde esta perspectiva metabólica, podemos distinguir dos tipos de funciones del agua: anabólicamente, la extracción de agua de moléculas (mediante reacciones químicas enzimáticas que consumen energía) permite el crecimiento de moléculas mayores, como los triglicéridos o las proteínas; en cuanto al catabolismo, el agua actúa como un disolvente de los enlaces entre átomos, reduciendo el tamaño de las moléculas (como glucosas, ácidos grasos y aminoácidos), suministrando energía en el proceso.
El agua es por tanto un medio irremplazable a nivel molecular para numerosos organismos vivos. Estos procesos metabólicos no podrían realizarse en un entorno sin agua, por lo que algunos científicos se han planteado la hipótesis de qué tipo de mecanismos (absorción de gas, asimilación de minerales) podrían mantener la vida sobre el planeta.
Es un compuesto esencial para la fotosíntesis y la respiración. Las células fotosintéticas utilizan la energía del sol para dividir el oxígeno y el hidrógeno presentes en la molécula de agua. El hidrógeno es combinado entonces con CO2 (absorbido del aire o del agua) para formar glucosa, liberando oxígeno en el proceso. Todas las células vivas utilizan algún tipo de "combustible" en el proceso de oxidación del hidrógeno y carbono para capturar la energía solar y procesar el agua y el CO2. Este proceso se denomina respiración celular.
El agua es también el eje de las funciones enzimáticas y la neutralidad respecto a ácidos y bases. Un ácido, un "donante" de ion de hidrógeno (H+, es decir, de un protón) puede ser neutralizado por una base, un "receptor" de protones, como un ion hidróxido (OH-) para formar agua. El agua se considera neutra, con un pH de 7. Los ácidos tienen valores pH por debajo de 7, mientras que las bases rebasan ese valor. El ácido gástrico (HCl), por ejemplo, es el que posibilita la digestión. Sin embargo, su efecto corrosivo sobre las paredes del esófago puede ser neutralizado gracias a una base como el hidróxido de aluminio, causando una reacción en la que se producen moléculas de agua y cloruro de sal de aluminio. La bioquímica humana relacionada con enzimas funciona de manera ideal alrededor de un valor pH biológicamente neutro de alrededor de 7.4.
Las diversas funciones que un organismo puede realizar, según su complejidad celular, determinan que la cantidad de agua varíe de un organismo a otro. Una célula de Escherichia coli contiene alrededor de un 70% de agua, un cuerpo humano entre un 60 y 70%, una planta puede reunir hasta un 90% de agua, y el porcentaje de agua de una medusa adulta oscila entre un 94 y un 98%.
Estructura de la molécula de agua
La molécula de agua está formada por dos átomos de hidrógeno y uno de oxígeno unidos por sendos enlaces covalentes polares.
 A pesar de tener una carga eléctrica neutra, se trata de una molécula dipolar, ya que poseé una región electropositiva y otra electronegativa. Esto se debe a que el átomo de oxígeno es más electronegativo que el átomo de hidrógeno, por lo que atrae con más fuerza a los electrones compartidos en cada enlace; por tanto, el enlace O-H está polarizado, aparecieno una densidad de carga negativa (-) en el oxígeno y una densidad de carga positiva (+) en el hidrógeno, mostrándose como un dipolo permanente cuyo polo negativo apunta al átomo de oxígeno y cuyo polo positivo se encuentra sobre la bisectriz del ángulo formado por los enlaces O-H.
A pesar de tener una carga eléctrica neutra, se trata de una molécula dipolar, ya que poseé una región electropositiva y otra electronegativa. Esto se debe a que el átomo de oxígeno es más electronegativo que el átomo de hidrógeno, por lo que atrae con más fuerza a los electrones compartidos en cada enlace; por tanto, el enlace O-H está polarizado, aparecieno una densidad de carga negativa (-) en el oxígeno y una densidad de carga positiva (+) en el hidrógeno, mostrándose como un dipolo permanente cuyo polo negativo apunta al átomo de oxígeno y cuyo polo positivo se encuentra sobre la bisectriz del ángulo formado por los enlaces O-H.
Esta estructura dipolar hace posible que la molécula de agua pueda atraer otras moléculas próximas, ya que el oxígeno de una molécula puede atrar el hidrógeno de otra molécula, estableciendo el enlace llamado puente de hidrógeno, una interacción débil si se compara con un enlace covalente o un enlace iónico.
Una molécula de agua puede llegar a formar hasta cuatro puentes de hidrógeno con otras moléculas, por lo que en el agua líquida se forma una extensa red o malla mantenida por estos enlaces, que están continuamente formándose y rompiéndose.
Disociación del agua
La conductividad del agua, aunque muy baja, permitió deducir que puede disociarse en iones, llamados hidronio o hidrogeniones (H+) e hidroxilo (OH-), que se encuentran también junto el agua molecular (H2O) en una mezcla normal acuosa (aq).
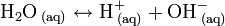
Esta disociación, en dirección a la derecha ocurre únicamente hasta que el equilibrio se alcanza, después ocurre en ambas direcciones a la misma velocidad. Aproximadamente una de cada 500 millones de moléculas de agua se disocia. La ecuación se puede escribir igual que la de cualquier disociación:
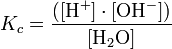
Siendo Kc la constante de disociación del agua, debido a que la disociación es prácticamente siempre la misma, se puede combinar con una nueva constante Kw:

Este producto iónico es constante, lo cual quiere decir que cualquier incremento en la concentración de uno de los iones implica una disminución en la concentración del otro, manteniéndose la constante mencionada.
Como en el agua pura la concentración de H3O+ y de OH- es la misma, eso significa que la concentración de cualquiera de ellos es de 1.0 x 10-7.
Cuando el agua contiene cualquier otra sustancia en disolución, puede alterarse la concentración de los hidrogeniones y entonces es cuando introducimos los términos acidez y alcalinidad.
- Una disolución acuosa es ácida cuando la concentración de H3O+ es mayor de 1.0 x 10-7.
- Una disolución acuosa es alcalina cuando la concentración de H3O+ es menor de 1.0 x 10-7.
- Una disolución acuosa es neutra cuando la concentración de H3O+ es igual a 1.0 x 10-7.
El pH (potencial de hidrógeno) es una medida de la acidez o alcalinidad de una disolución, que indica la concentración de iones hidronio (H3O+) presentes en determinadas sustancias. La sigla significa "potencial de hidrógeno" (pondus Hydrogenii o potentia Hydrogenii; del latín pondus, n. = peso; potentia, f. = potencia; hydrogenium, n. = hidrógeno). Este término fue acuñado por el químico danés Sørensen, quien lo definió como el logaritmo negativo de base 10 de la actividad de los iones hidrógeno. Esto es:
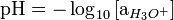
- Disolución ácida: pH < 7.
- Disolución neutra: pH = 7.
- Disolución alcalina o básica: pH > 7.
En la siguiente imagen se muestran algunos valores del pH de diferentes fluidos, mostrando que en general la vida se desarrolla en valores de pH cercanos a la neutralidad.

En los seres vivos es muy importante que el pH de sus fluidos no cambie bruscamente, ya que podría ocasionar daños irreversibles al producir cambios en la estructura de muchas biomoléculas o incluso la alteración de muchas reacciones químicas. Para ello, en las soluciones acuosas de los seres vivos existen unos mecanismos para evitar estas variaciones que se conocen como sistemas tampón o amortiguadores de pH.
Estos sistemas tampón están basados en las propiedades de los ácidos débiles, ácidos que no se disocian totalmente, por lo que en un intervalo determinado de pH pueden actuar como donantes o receptores de hidrogeniones sin que cambie apenas el pH del fluido.
Entre los más conocidos están el tampón bicarbonato y el tampón fosfato.
El tampón bicarbonato es el más importante en los medios intercelulares de los seres vivos. Se encarga de mantener el pH en valores próximos a 7.4 gracias al equilibrio que se establece entre el ión bicarbonato y el ácido carbónico, que se disocia a su vez en dióxido de carbono y agua.

Si aumenta la concentración de hidrogeniones en el medio por cualquier motivo fisiológico, el equilibrio se desplaza a la derecha, eliminando el exceso de CO2 por la respiración. Si por el contrario disminuye la concentración de hidrogeniones, el equilibrio se desplaza a la izquierda, tomando el CO2 del exterior.
El tampón fosfato es el más importante en las soluciones intracelulares y mantiene el pH alrededor del 6.86 debido al equilibrio entre los fosfatos monobásico y dibásico:

Propiedades fisíco - químicas del agua
La estructura dipolar de la molécula de agua y la presencia de enlaces de hidrógeno confieren al agua una serie de propiedades físico - químicas muy peculares que han permitido a los seres vivos sobrevivir. Entre estas propiedades merecen la pena destacarse:
 Elevado calor de varporización. El punto de ebullición del agua (y de cualquier otro líquido) está directamente relacionado con la presión atmosférica. Por ejemplo, en la cima del Everest, el agua hierve a unos 68º C, mientras que al nivel del mar este valor sube hasta 100º. Del mismo modo, el agua cercana a fuentes geotérmicas puede alcanzar temperaturas de cientos de grados centígrados y seguir siendo líquida. Su temperatura crítica es de 373,85 °C (647,14 K), su valor específico de fusión es de 0,334 kJ/g y su índice específico de vaporización es de 2,23kJ/g.
Elevado calor de varporización. El punto de ebullición del agua (y de cualquier otro líquido) está directamente relacionado con la presión atmosférica. Por ejemplo, en la cima del Everest, el agua hierve a unos 68º C, mientras que al nivel del mar este valor sube hasta 100º. Del mismo modo, el agua cercana a fuentes geotérmicas puede alcanzar temperaturas de cientos de grados centígrados y seguir siendo líquida. Su temperatura crítica es de 373,85 °C (647,14 K), su valor específico de fusión es de 0,334 kJ/g y su índice específico de vaporización es de 2,23kJ/g.- Elevado momento dipolar. Ya que el oxígeno tiene una electronegatividad superior a la del hidrógeno, el agua es una molécula polar. El oxígeno tiene una ligera carga negativa, mientras que los átomos de hidrógenos tienen una carga ligeramente positiva del que resulta un fuerte momento dipolar eléctrico. La interacción entre los diferentes dipolos eléctricos de una molécula causa una atracción en red que explica el elevado índice de tensión superficial del agua.
- Elevada fuerza de cohesión - adhesión. La fuerza de interacción de la tensión superficial del agua es la fuerza de van der Waals entre moléculas de agua. La aparente elasticidad causada por la tensión superficial explica la formación de ondas capilares. A presión constante, el índice de tensión superficial del agua disminuye al aumentar su temperatura. También tiene un alto valor adhesivo gracias a su naturaleza polar.
- El agua es un disolvente muy potente, al que se ha catalogado como el disolvente universal, y afecta a muchos tipos de sustancias distintas. Las sustancias que se mezclan y se disuelven bien en agua -como las sales, azúcares, ácidos, álcalis, y algunos gases (como el oxígeno o el dióxido de carbono, mediante carbonación)- son llamadas hidrófilas, mientras que las que no combinan bien con el agua -como lípidos y grasas- se denominan sustancias hidrofóbicas. Todos los componentes principales de las células de proteínas, ADN y polisacáridos se disuelven en agua. Puede formar un azeótropo con muchos otros disolventes.
- La capilaridad se refiere a la tendencia del agua de moverse por un tubo estrecho en contra de la fuerza de la gravedad. Esta propiedad es aprovechada por todas las plantas vasculares, como los árboles.
- El agua es miscible con muchos líquidos, como el etanol, y en cualquier proporción, formando un líquido homogéneo. Por otra parte, los aceites son inmiscibles con el agua, y forman capas de variable densidad sobre la superficie del agua. Como cualquier gas, el vapor de agua es miscible completamente con el aire.
- El agua pura tiene una conductividad eléctrica relativamente baja, pero ese valor se incrementa significativamente con la disolución de una pequeña cantidad de material iónico, como el cloruro de sodio.
- El agua tiene el segundo índice más alto de capacidad calorífica específica -sólo por detrás del amoníaco- así como una elevada entalpía de vaporización (40.65 kJ mol-1); ambos factores se deben al enlace de hidrógeno entre moléculas. Estas dos inusuales propiedades son las que hacen que el agua "modere" las temperaturas terrestres, reconduciendo grandes variaciones de energía.
- La densidad del agua líquida es muy estable y varía poco con los cambios de temperatura y presión. A la presión normal (1 atmósfera), el agua líquida tiene una mínima densidad (0,958 kg/l) a los 100 °C. Al bajar la temperatura, aumenta la densidad (por ejemplo, a 90 °C tiene 0,965 kg/l) y ese aumento es constante hasta llegar a los 3,8 °C donde alcanza una densidad de 1 kg/litro. Esa temperatura (3,8 °C) representa un punto de inflexión y es cuando alcanza su máxima densidad (a la presión mencionada). A partir de ese punto, al bajar la temperatura, la densidad comienza a disminuir, aunque muy lentamente (casi nada en la práctica), hasta que a los 0° disminuye hasta 0,9999 kg/litro. Cuando pasa al estado sólido (a 0 °C), ocurre una brusca disminución de la densidad pasando de 0,9999 kg/l a 0,917 kg/l.
Funciones biológicas del agua
Como consecuencia de las propiedades inherentes a su estructura, el agua realiza funciones biológicas imprescindibles para el mantenimiento de la vida.
- Función termorreguladora. El elevado calor específico del agua permite mantener constante la temperatura interna de los seres vivos, convirtiéndola en un buen amortiguador térmico, impidiendo que cambios bruscos de temperatura externa afecten a los organismos. El elevado calor de vaporización explica la disminución de temperatura que experimenta un organismo cuando el agua se evapora en la superficie del cuerpo de un ser vivo (el sudor enfría el cuerpo al evaporarse). Ayuda a mantener constante la temperatura de los animales homeotermos.
- Función disolvente. El agua, además de disociar compuestos iónicos, puede manifestar también su acción como disolvente mediante el establecimiento de enlaces de hidrógeno con otras moléculas que contienen grupos funcionales polares, como alcoholes, aldehídos o cetonas, provocando su dispersión o disolución. Es un disolvente casi universal, por lo que es muy importante para el transporte de sustancias por el organismos (nutritivas o de desecho).
- Función estructural. La elevada cohesión de las moléculas permite al agua dar volumen a las células, turgencia a las plantes e incluso actuar como esqueleto hidrostático en algunos animales invertebrados. También explica las deformaciones que experimentan algunas estructuras celulares como el citoplasma.
- Función mecánica. El agua, al ser un líquido capaz de disolver diversas sustancias, puede originar líquidos de varias viscosidades, lo que le permite actuar como lubrificante. Al ser un líquido incompresible le permite ejercer esta función en las articulaciones de los animales vertebrados, lo que evita el contacto entre los huesos, convirtiéndolo en amortiguador.
- Función química. La disociación iónica del agua le permite intervenir en muchas reacciones químicas, aportando hidrogeniones o hidroxilos al medio. También es la fuente de átomos de hidrógeno en la fotosíntesis.

Juan Luis Menéndez
Me gusta la divulgación de la naturaleza y el patrimonio cultural, motivos por los que he decidido comenzar el desarrollo de asturnatura.com. Soy un amante de la botánica y la geología.
Comparte en:
Índice:
Más populares en Bioquímica:
 Fases de la Meiosis
Fases de la Meiosis Los monosacáridos
Los monosacáridosPalabras clave:
Artículos similares
Citar como
Menéndez Valderrey, Juan Luis. "El agua". asturnatura.com [en línea] Num. 325, 20/06/2011 [consultado el 17/4/2025]. Disponible en https://www.asturnatura.com.
ISSN 1887-5068